-
眼睛是人体最重要和最精密的感觉器官,个人感知的外界日常信息中有80%是通过眼睛获取。视网膜眼底成像可以及早诊断和治疗眼部视力疾病,以保证患者视力。除此之外,许多全身性疾病(如包括高血压、糖尿病、肾病等)也会在视网膜上,特别是视网膜血管上有所体现,因此眼部高分辨率的视网膜细胞和微细血管成像已经成为眼科疾病诊疗、重大疾病早期诊断的重要手段。
常用的视网膜成像方法有很多种,主要包括眼底相机(Fundus Camera)[1-3]、扫描激光检眼镜(Scanning Laser Ophthalmoscope,SLO)[4-5]、光学相干层析成像(Optical Coherence Tomography,OCT)[6]和眼底荧光血管造影[7]等。而光学相干层析作为一种在体、无创、实时、高分辨率断层成像的新技术,近年来发展迅猛,不仅可以提供组织的横截面图像,而且可以在短时间内生成样本的完整3D信息[8],已经成为一种不可或缺的眼科成像诊断工具。现有的OCT轴向分辨率在1~15 μm左右,而其横向分辨率则主要由系统光斑的聚焦程度决定,会受到系统衍射和像差的影响,一般均只能达到约15~20 μm,不能实现衍射极限成像[9]。基于OCT轴向和横向分辨率可以解耦,自适应光学(Adaptive Optics,AO)可以进行波前主动校正的特点,将AO技术与OCT系统相结合,可以在不影响原有OCT系统轴向分辨率的条件下,提高系统的横向分辨率,以实现各向同性衍射极限分辨率的视网膜细胞及微细血管成像。OCT已逐步成为除荧光显微成像之外,自适应光学在医学领域的又一个重要研究方向。目前国内外众多科研机构都在开展相关研究,以期实现视网膜实时、活体、高分辨率的三维立体成像。
-
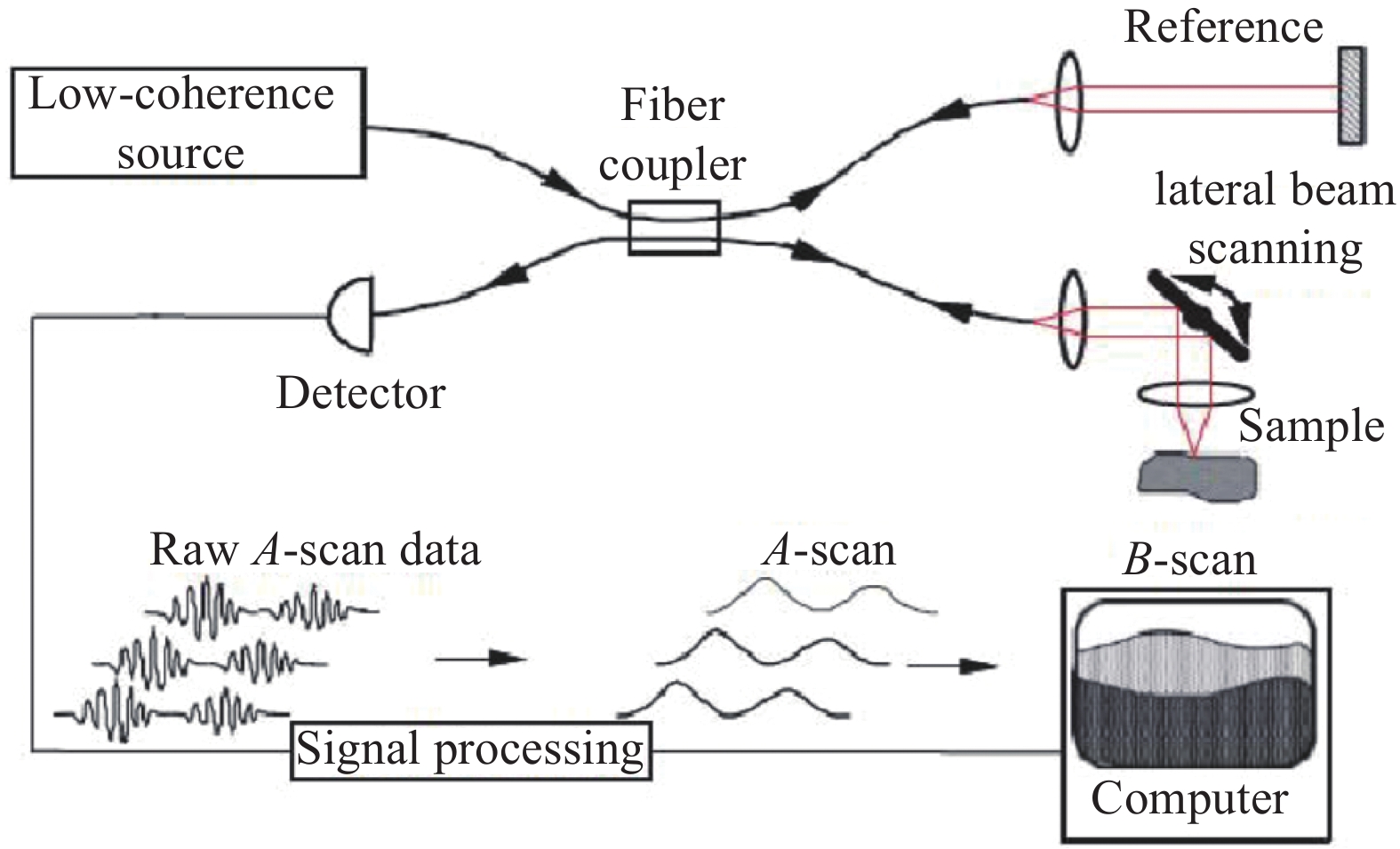
1991年,美国麻省理工学院的D.Huang等人首次提出OCT概念,采用OCT技术成功地对人眼视网膜的显微结构和冠状动脉壁成像,轴向分辨率达到10 μm[10]。1993年,Swanson等[6]人演示了人类视网膜的活体光学相干层析成像,其原理如图1所示,OCT系统将低相干光源发出的光线通过光线偶联器分成两束,一束发射到被测物体,即被检查者眼内,称为信号臂,另一束发射到干涉仪内的参照反光镜,称为参考臂。把信号臂和参考臂反射回来的两束光信号叠加,当信号臂和参考臂长度一致时,就会发生干涉。从眼球中反射回来的光信号随组织的形状而显示不同的强弱,产生明暗灰阶变化的OCT图像,经过伪彩处理后得到视网膜横断面图像。
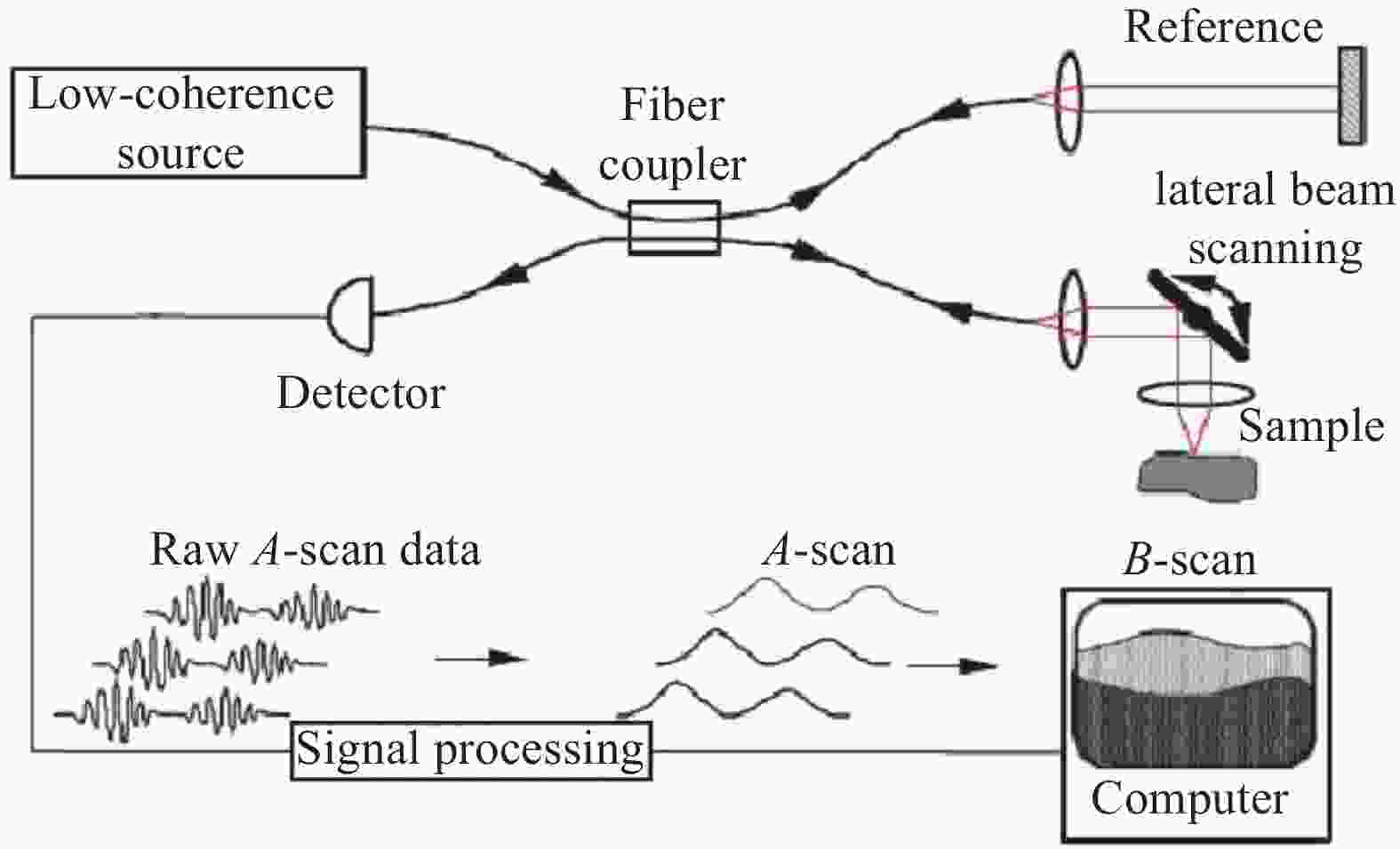
Figure 1. OCT system based on optical fiber[6]
根据光学相干层析具体成像原理和数据处理方式的不同,可分为时域OCT(Time Domain OCT,TD-OCT)、谱域OCT (Spectral-Domain OCT,SD-OCT)和扫描源OCT (Swept-Source OCT,SS-OCT)三种形式,具有点扫描、线场和全场三种照明和检测方案。时域OCT采用宽带连续或准连续光源,参考臂采用机械方式进行Z轴轴向扫描(A-scan),通过点探测器接收不同深度扫描的散射光干涉信号以获取样品不同深度的信息。谱域OCT采用与时域OCT相同的光源,利用分光镜实现干涉,通过光谱仪的光栅衍射出不同波长的光信息,最终由线阵探测器接收并利用傅里叶变换重建深度扫描(A-scan)信息。扫描源OCT采用与时域和谱域OCT不同的可调节波长光源,该光源发出一系列连续波长的相干光,利用点探测器接收不同波长相干光干涉后的强度,重建得到所有波长的干涉信号图。谱域OCT和扫描源OCT都是基于傅里叶变换分析的频域OCT,省去了时域OCT参考臂机械式的Z轴扫描(A-scan)过程,成像速度大幅度提高,已几乎完全取代时域OCT的应用。由于眼睛体液是透明的,谱域OCT常使用宽带超辐射发光二极管(Super Luminescent Diode,SLD)作为光源,在700~900 nm的光谱范围进行OCT成像。而扫描源OCT通过研制不同的基于傅里叶域锁模(Fourier-Domain Mode Locked,FDML)激光器的超宽带波长扫描源,可以在1 040 nm、1 300 nm和1 700 nm等低吸水率窗口进行生物透明成像,具有更深入的穿透能力。时域OCT、谱域OCT和扫描源OCT的具体工作形式和特性对比如表1所示。
TD-OCT Frequency domain OCT SD-OCT SS-OCT Illuminant Wide spectrum, continuous/quasi continuous light Wide spectrum, continuous/quasi continuous light Sweep light source Reference arm Mechanical Fixed Fixed Detector Point detector Line detector Point detector Imaging speed Slow Fast Fast SNR Low High High Table 1. Comparison of TD-OCT, SD-OCT and SS-OCT
-
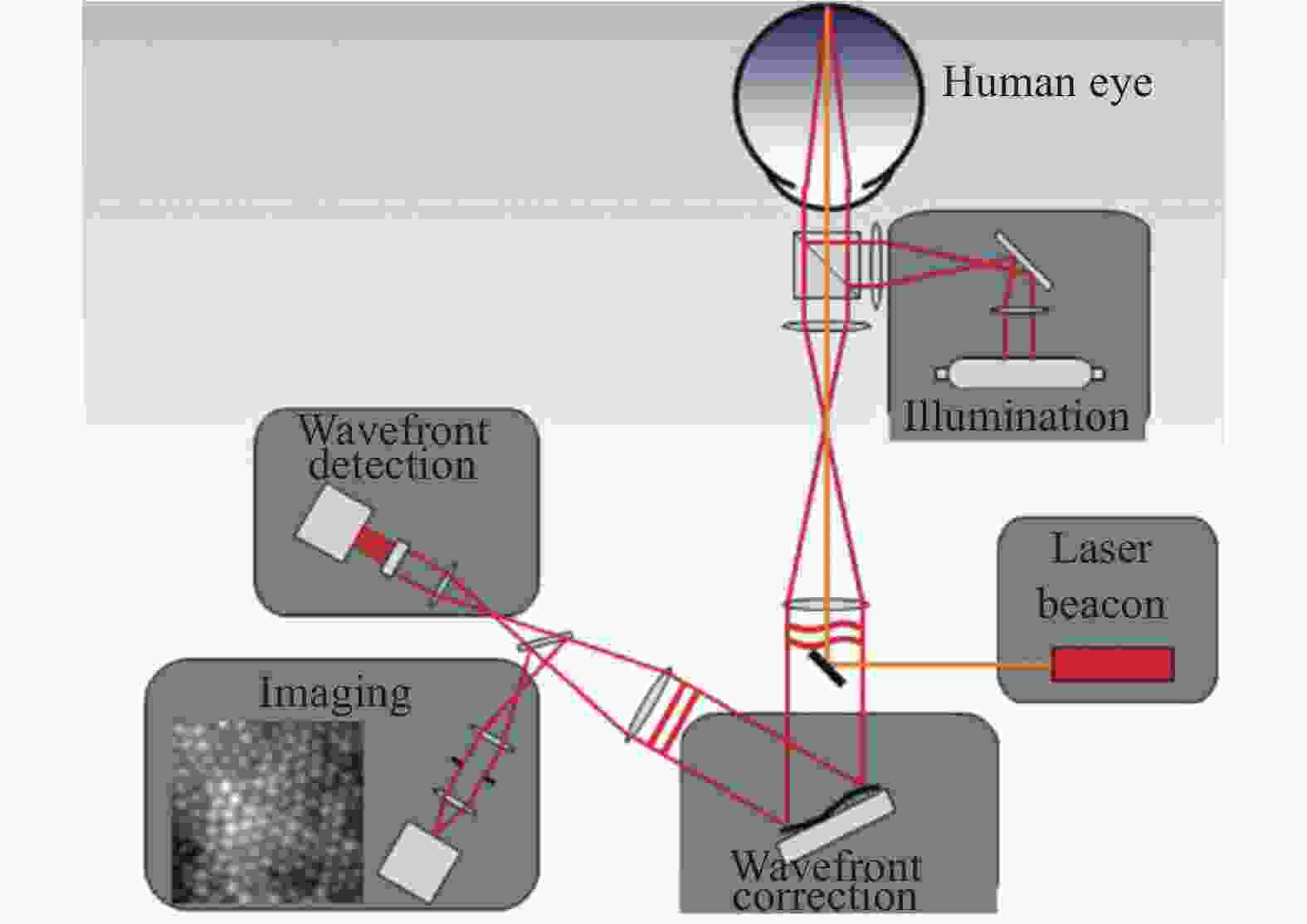
自适应光学是一项波前校正技术。当光在湍流或有像差的光学系统中传播时,波前畸变会导致成像的模糊,通过自适应光学系统,可以获得衍射极限的图像。现如今,自适应光学技术应用越来越广泛,世界各地的大型地基望远镜均匹配有自适应光学系统[11]。同时,自适应光学也被研究用于高能激光波前整形[12]、激光加工[13],流场测速[14]、同步辐射光源[15]、眼底视网膜微血管清晰成像[16]、荧光显微镜生物组织清晰成像[17]等多个领域,以提高成像的分辨率和质量,不论是在离体还是在体检测均有着巨大的应用潜力。在眼底视网膜成像应用中,成像分辨率主要由光瞳的尺寸和眼光学系统的像差决定。对于前者而言,散瞳可以扩大瞳孔的尺寸,从而改善成像分辨率;对于后者来说,自适应光学系统可以改善眼光学系统的像差。
经典的自适应光学系统主要由波前传感组件、波前校正组件和控制器等三部分组成。图2为应用于人眼视网膜成像的自适应光学系统原理图,在系统工作时首先利用一束照明光入射到人眼视网膜上,眼底的散射光经过人眼屈光系统后出瞳并进入波前探测器,此时该散射光已经携带了人眼的波前像差信息。波前探测器完成波前像差探测后,将信息传送给控制计算机。在计算机中完成波前畸变重构,并将控制信号反馈给波前校正器,波前校正器按照控制信号产生共扼波面,对波前像差进行补偿,实现自适应光学实时校正,以在成像相机上获得清晰的视网膜图像。
-
波前传感和波前校正是自适应光学系统的两个关键技术,常用的波前传感技术主要包括夏克−哈特曼(Shack-Hartman)波前传感[18]和金字塔波前传感[19]等,AO-OCT系统一般采用Shack-Hartman波前传感器(Shack Hartman Wavefront Sensor,SHWS)作为波前探测器,但其只能探测波前像差的横向分布,对波前像差沿深度方向的变化不敏感,并且易受杂散光影响。
针对传统波前传感技术的不足,相干门波前传感(Coherence Gated Wavefront Sensing,CGWS)技术采用干涉原理测量波前像差,基于低相干干涉仪,结合相移干涉法和物理或虚拟Shack-Hartmann传感器,以重建像差,用于波前校正[20-21]。由于相干门的存在,相干门波前传感技术能够消除杂散反射,即使在强散射样品中也能测量样品引入的波前畸变,并且只对与参考臂光程接近相等的那一层像差进行采集和校正,非常适用于高分辨率成像时波前像差的动态校正。与此同时,OCT作为一种干涉成像技术,可无缝地和相干门波前传感技术结合,以在同一套系统上同时完成波前探测和成像。
2007年,Rueckel等[22]从理论和实验两方面研究了相干门控波前传感的性能,将模型的蒙特卡洛模拟与试验样品的实验结果进行比较。2011~2012年间,Wang等[23-24]基于马赫−曾德尔干涉仪和Shack-Hartmann波前传感器的结合,分别在时域和频域使用相干选通技术以提高物理Shack-Hartmann波前传感器的波前传感深度分辨率,利用窄相干选通,消除了图像中的杂散反射,信号强度得到增强,信噪比也有所提高。2015年,Wang等[25]用相干门控Shack-Hartman波前传感技术测量不同深度的波前像差,相干门基于扫描源(Swept Source)干涉测量原理,波前传感的深度分辨率为7.1 μm。
在AO-OCT中,目前使用最广泛的波前校正器是变形镜(Deformable Mirror,DM),如微机械变形镜(Micro-Mechanical Deformable Mirror,MMDM)和压电变形镜(Piezoelectric Deformable Mirror,PDM)[26-31],但由于其空间分辨率低、位相调制量小、体积大、成本高、加工周期长等缺点,近年来,液晶空间光调制器[32]和分段镜[33-34]等波前校正器也得到迅速发展。
针对人眼像差的高变异性,一些研究团体建议使用两种规格不同的变形镜(DMs)来解决像差校正问题[35-36],其中,变形镜1 (DM1)由少量大行程促动器组成,以校正较大幅度的低阶像差(例如散焦和像散),变形镜2 (DM2)由大量小行程的促动器组成,以校正高阶像差,两种变形镜配合使用可以补偿各种像差。
-
2004年,Hermann等[26]将时域OCT系统与相干门控AO眼底相机[37]相结合并首次应用于活体人眼视网膜成像,由于时域OCT系统成像速度较低(125~250 Hz),因此无法完成实时三维成像。
2005年,Vienna大学的Fernndez E J等人[32]将基于液晶可编程相位调制器(Programmable Phase Modulator,PPM)的自适应光学系统应用到UHR OCT (Ultra High-Resolution Optical Coherence Tomography)中,以高达25 000次A-scan/s,拍摄到了清晰度更高的视网膜细胞图像。
2005年,Yan Zhang等[27]基于自由空间平行照明结构和自适应光学,开发了一种新的光谱域OCT (SD-OCT)相机,在AO系统以14 Hz频率进行动态校正的同时,以500 Hz的频率进行活体视网膜的短脉冲窄B扫描(100
$ \times $ 560 μm),获得了当时活体人眼中B扫描的最高三维分辨率(3.0 μm$ \times $ 3.0 μm$ \times $ 5.7 μm)。同年,美国California大学的Zawadzhi等人[28]在SD-OCT中引入基于压电变形镜的自适应光学系统,也正是这一年标志着光谱域OCT与AO的结合。在实现微观横向分辨率时,光谱域OCT的聚焦深度(Depth of Focus,DOF)将减小到只有几十微米,严格限制了SD-OCT的应用范围。因此在SD-OCT基础上发展出基于B扫描技术的En face OCT,以在整个成像深度保持高横向分辨率。2006年,M. Pircher等[38]首次将En-face OCT与SLO相结合同步成像,系统以2 Hz的帧速进行C扫描成像,自适应光学系统以9 Hz的频率闭环校正人眼像差,将横向分辨率由校正前的6.5 μm提高到5 μm。
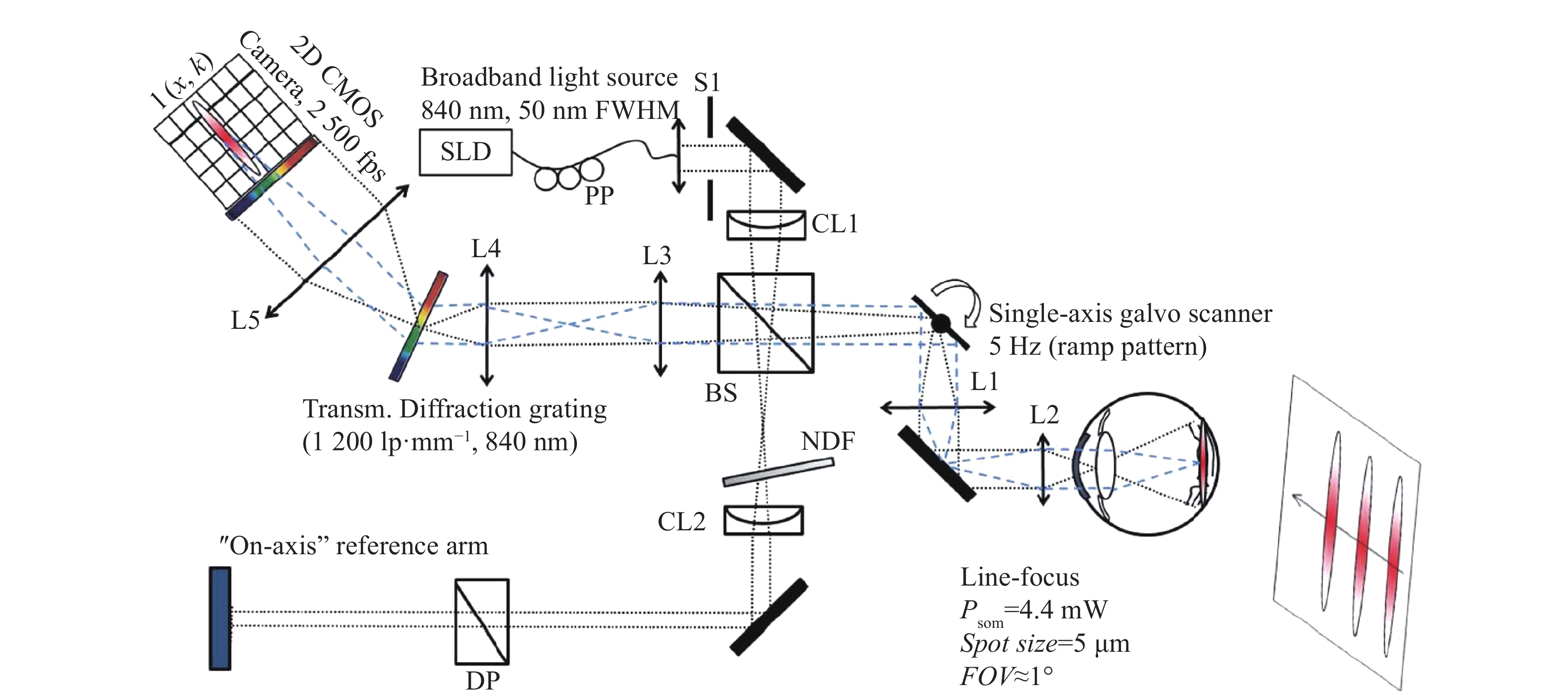
2017年,Ginner等[39]设计如图3所示的线场光谱域OCT系统,利用非迭代的数字像差校正(Digital Aberration Correction, DAC)方法,以2.5 kHz的速率实现在体视网膜OCT细胞级分辨率成像。

Figure 3. Schematic diagram of line field spectral domain OCT[39]
图中,NDF表示中性密度滤光片;BS表示50/50分束器;S1表示圆形出瞳;PP表示偏振桨;CL1和CL2表示圆柱形透镜;L表示消色差透镜;DP表示色散补偿。黑色虚线表示水平照明路径;蓝色虚线表示正交平面。
-
利用扫描激光源进行光学频域成像(Optical Frequency Domain Imaging,OFDI)是一种新兴的第二代光学相干层析成像(OCT)方法,也称之为扫描源光学相干层析成像(Swept-Source OCT,SS-OCT),是一种利用波长扫描光源探测组织后向散射光振幅和相位的新方法[40]。相关研究表明,1 040 nm的光谱范围是视网膜成像的一个低吸水率备选操作窗口,可以在高度吸收和散射的视网膜色素上皮下提供更深入的脉络膜穿透[41-43]。而低吸水率窗口波长的宽调谐快速扫描光源的研制严重影响扫描源OCT在视网膜成像中的应用,基于1 300 nm波长范围的快速可调谐激光器的开发,SS-OCT可用于皮肤、冠状动脉、食道和眼前节的成像[44-45]。2019年,Kowalczyk等[46]设计了基于YbCaF2激光器全锁模的超宽带波长扫描源,光谱带宽485 nm到1 800 nm,可以在7~21.5 MHz之间调节扫频,不需要额外的强度调制器,使在1 300 nm和1 700 nm进行生物透明成像成为可能。
2006年,Lee等[47]研制了中心波长为1050 nm的高性能波长扫描激光器和SS-OCT系统,以18.8 kHz的A扫描速率,第一次展示了在活体人眼后端的SS-OCT成像。2010年,Kurokawa[48]用1030 nm的探测光束开发了自适应光学相干层析成像(AO-OCT)系统,以47 000行/s的轴向扫描速率进行高穿透、高分辨率视网膜成像。同年,M. Mujat[49]第一次将SLO和波长为1000 nm的SS-OCT两种成像模式结合,并用AO进行校正,以增加对脉络膜毛细血管和脉络膜的穿透和可视化。目前最快的图像采样速率是Klein和Grulkowski设计的波长为1050 nm的SS-OCT系统实现的6.7 MHz[50-51]。2016年,Yifan Jian等[52]提出将无波前传感器自适应光学元件与双变形透射光学元件相结合,基于紧凑透镜设计了一种成像波长为1060 nm的SS-OCT系统,以实现视网膜近衍射极限成像性能。2019年,Azimipour等[53-54]设计了如图4所示的由傅里叶域锁模激光器和AO系统组成的光栅扫描系统,将SLO和OCT结合并使用相同的扫描源,在中心波长1063 nm的宽谱范围内以1.6 MHz的A扫描速率进行活体视网膜成像,实现衍射极限的细胞分辨率。

Figure 4. Optical schematic diagram of AO scanning system[54]
图中,DM表示变形镜;SHWS表示Shack-Hartmann波前传感器;AL表示消色差透镜;S表示球面镜;FM表示平面镜;BS表示分束器;DBS表示分色分束器;HS表示水平扫描仪;VS表示垂直扫描仪;BD表示光束转储;OI表示光隔离器。
-
1998年,中国科学院成都光电技术研究所就已开展自适应光学在眼底相机和扫描激光检眼镜(SLO)视网膜高分辨率成像的研究[55],但在自适应光学的OCT高分辨率视网膜成像技术方面,国内率先开始研究的是深圳大学光电子学研究所的屈军乐。2004年,深圳大学的屈军乐与美国Indiana大学合作[56],搭建了基于CCD相机的平行相干光层析扫描和自适应光学系统,其轴向点扩展函数和灵敏度分别为10 μm和76 dB,为了实现视网膜的二维高分辨率成像,系统将一幅视网膜干涉图像的平均生成时间控制在1.75 ms以内,以降低眼球运动对成像质量的影响,该系统实验表明基于自适应光学的视网膜光学相干层析成像系统的空间分辨率和灵敏度远远高于其他基于自适应光学的视网膜成像技术。
2007年,中国科学院成都光电技术研究所张雨东等[57]将AO与SD-OCT结合,设计了光纤型光学相干层析成像系统,利用37单元变形反射镜对人眼波前像差进行实时校正,对离体兔子视网膜进行OCT成像,获得接近衍射极限的横向分辨率。2011年,上海交通大学生命科学与技术学院任秋实教授[58]对包括AO-OCT在内的先进眼科多模态成像技术展开研究,搭建高分辨率频域OCT系统,成功实现了人眼和活体大鼠眼的在体视网膜快速成像。2012年,南京航空航天大学钮赛赛[59]搭建了基于自适应光学高分辨率微型成像系统样机,经国家有关机构检测,成像系统在人眼视网膜上分辨尺寸约为2.36 μm,视场角约为±3.0°
$ \times $ ±3.0°,实际放大倍率约为8.03。对人眼像差测量、校正的频率为11~15 Hz,残余像差RMS值低于0.1$\lambda $ ,可以获得高分辨率眼底视网膜图像。2014年,中国科学院长春光学精密机械与物理研究所[60-61]对基于液晶自适应光学的视网膜成像系统进行优化,目前已可实现高分辨率微血管成像,通过抑制眼内杂散光的影响,显著提高对比度和清晰度。2015年,南京航空航天大学梁春课题组[62]搭建出一套基于双变形镜的自适应光学视网膜成像系统,可实现人眼像差的测量、校正及视网膜成像。在各高校和科研机构的共同努力下,国内自适应光学相干层析技术不断发展和成熟,已经可以实现神经纤维层、小毛细血管网络和感光细胞的活体视网膜高分辨率成像,并在逐步向临床应用发展,与此同时,AO-OCT在血管造影等新领域的应用也逐步成为研究热点。
-
针对传统OCT的宽带光源色差、活体成像时眼球运动伪影、高分辨成像视场不足等缺点,自适应光学通过波前传感和主动校正技术校正系统宽带光源色差和单色像差提高横向分辨率,通过高速成像和图像配准减少活体成像时眼球运动伪影,扩大自适应光学视场以在更大视场内进行各向同性高分辨率成像。而进一步,随着AO-OCT系统功能和性能的不断发展和进步,系统也逐渐面临结构更加复杂,临床应用难度大的问题,因此无波前传感器的AO校正和计算波前校正技术不断发展以简化AO-OCT的波前传感和校正系统,以期最终实现大视场、高效率、高灵敏度、高分辨率的高速人眼视网膜成像。
-
由于OCT轴向分辨率与系统所使用光源的中心波长负相关,与光谱带宽正相关,因此OCT常使用宽带光源以实现高轴向分辨率。但对于宽光谱带宽的光源,除了需要对中心波长进行最佳校正外,AO-OCT还需要考虑校正色差,才能进一步提高AO-OCT的各向分辨率。色差主要分为影响焦点轴向位置的纵向色差(Longitudinal Chromatic Aberration,LCA)和在偏离色轴位置对眼睛进行成像或扫描时产生不同折射的横向色差(Transverse Chromatic Aberration,TCA )。OCT成像时的纵向和横向色差都与成像波长相关,在840 nm处成像时,纵向色差和横向色差都大于50 nm[63],不能忽略;在可见光范围内(330~780 nm),LCA大约为2.5屈光度[64];在红外区域(780~900 nm),纵向色差减小到大约0.4屈光度[63]。但当同时使用波长在543~711 nm光谱范围的可见光和波长为842 nm的红外光时,横向色差非常明显[65]。2008年,Fernández[66]利用具有140 nm带宽的超宽带宽钛−蓝宝石激光器进行OCT成像,通过特殊设计的透镜和电磁驱动的大行程变形镜校正色差和单色像差实现全光校正,各向同性分辨率约为2-3 μm。同年,Zawadzki[67]通过一个定制的消色差透镜,校正眼睛和超宽带光源(波长836 nm,带宽112 nm)的LCA,通过眼睛的侧向偏移来补偿TCA,配合AO实现各向同性三维分辨率为3.5 μm×3.5 μm×3.5 μm的衍射极限成像。
-
进行活体视网膜成像时,即使在正常注视下人眼也会发生不自主的眼球运动,为了校正眼球运动对活体视网膜OCT成像的影响,目前常用的方法主要有配备附属AO-SLO采样通道、采用图像后处理技术和设计动态视网膜跟踪器等方法,这些方法的效率都会随着图像采集速度的提高而显著提高。
在配备附属AO-SLO采样通道方面,2011年,Zawadzki等[68]在SD-OCT和SLO结合模式下应用自适应光学技术,两个采样通道自动进行共配准,以直接比较两种成像模式的视网膜形态和潜在功能;2014年,Felberer等[69]设计了SLO和En face OCT结合的三维成像系统,在后处理中利用SLO提供的信息校正眼球横向运动,配备高速轴向眼动跟踪器以校正眼球的轴向运动。
在图像后处理技术方面,2011年,Kocaoglu等[70]采用高速CMOS摄像机(125 kHz)和新的基于特征的图像配准和去扭曲算法,将图像中的运动伪影从15 μm减小到1.3 μm均方根,足以识别和跟踪感光锥状细胞;2018年,Azimipour等[71]使用条带互相关统计中的偏差以校正光栅扫描自适应光学图像在参考帧中的运动伪影,比较未校正图像与校正图像的相关性,以量化运动伪影对图像功率谱的影响。
在设计动态视网膜跟踪器方面,2014年,印第安纳大学的Kocaoglu等[72]在第二代AO-OCT系统的样本臂上设计了一个定制的视网膜跟踪模块,以校正高达100 Hz的眼球运动,并将残余运动减少到10 μm均方根。
-
限制AO-OCT视场的因素主要有两个,一个是人眼瞳孔能实现AO校正的有限等晕角范围,AO一般只能实现等晕角范围内的像差校正,等晕角外的像差超出了AO的校正范围。由于人眼瞳孔大小以及成像波长都会影响视网膜的等晕角,有限的等晕角将AO的视场限制在视网膜上0.5°~2°的小范围内[73],该限制的解决途径是设计更大校正视场的光学系统。2009年,Thaung等[74]设计了一个使用五个视网膜导星和两个变形镜的实时双共轭自适应光学(Dual-Conjugate Adaptive Optics,DCAO)系统以在活体视网膜上进行宽视场高分辨率成像,衍射极限成像(Strehl≥0.8)的校正视场直径从传统单共轭AO (Single Conjugate Adaptive Optics,SCAO)的1.5°增加到DCAO的6.5°。
另一个限制AO-OCT视场的因素是可用的A扫描速率,对于三维OCT成像,这个因素将是更关键的。而兆赫扫描速率OCT系统的研制有望解决视场限制问题,并有利于减少眼球运动产生的伪影,增加图像采样频率,改进OCT图像的配准和后处理。2011年,Klein等[75]使用1 050 nm波长的傅里叶域锁模(FDML)激光器实现超高速超宽视场扫描源视网膜OCT成像,在70°视场设计了684 kHz和1.37 MHz的两种轴向扫描配置,实现的轴向分辨率为12 μm(684 kHz)和19 μm (1.37 MHz)。2014年,Kocaoglu等[72]设计了基于四个高速分光计组成的新检测通道和多相机自适应光学系统,实现790 nm波长下1 MHz A扫描速率的宽视场视网膜OCT,轴向分辨率为5.3 μm。
-
波前探测主要分为由已采集图像的质量提供校正反馈的无波前传感的间接波前探测和利用波前传感器对畸变波前进行直接测量的直接波前探测。大多数无波前传感器的AO-OCT系统,使用诸如强度或清晰度度量已采集图像的质量取代波前传感器作为AO系统的传感元件评估波前修正的效果[33, 76-79]。由于没有光学成像元件的限制,无波前传感器的AO可以大大简化AO-OCT系统。但由于目前视网膜波前无传感器系统的像差通常是串行补偿的,系统校正速度慢,降低了校正随时间变化像差的能力。2015年,Verstraete等[80]将传统的坐标搜索方法、NEWUOA (NEW Unconstrained Optimization Algorithm)优化算法的二次模型和基于数据的在线非线性极值搜索(Data-based Online Nonlinear Extremumseeker,DONE)等三种OCT无传感波前像差校正方法进行了实验对比,DONE方法明显优于NEWUOA方法,图像质量得到了显著改善。2017年,Polans等[81]设计了一种新的宽视场(>70°)光学相干层析成像系统(Wide Field OCT,WF-OCT),配备波前无传感自适应光学系统(Wavefront Sensorless Adaptive Optics,WSAO),用直径3 mm的光束在10 s内对视网膜周边较小(<25°)靶区进行低阶和高阶波前校正。同年,Verstraete等[82]使用单次迭代时间为1 ms的DONE算法将图像质量和OCT信号强度提高到原来的7倍,在2.8 s内使用70次DONE迭代校正三维OCT成像的五个像差。
-
像差校正可以使用硬件元件对光学波前进行物理校正,也可以在计算成像的图像重建过程中对波前进行数字修正。作为相干成像技术,OCT可以获得光场的相位,从而检测出视网膜返回的全电场,由于相位可以在后处理中进行控制,奠定了实现无校正装置自适应光学的理论基础。与传统的基于硬件的自适应光学技术相比,光学像差的数值校正是一种廉价且简单的替代方案,常用于OCT B扫描或OCT三维成像波前像差校正。
2015年,Kumar等[83]提出了基于子孔径的数字自适应光学(Digital Adaptive Optics,DAO)系统,该系统在0.6的数值孔径下,有限聚焦深度约为7 μm,在218 μm深度范围内可以实现亚微米横向分辨率。2016年,Pande等[84]提出了一个自动计算像差校正宽带干涉成像的方法,在傅里叶域将像差校正过程建模为使用相位滤波器对畸变图像进行滤波操作,用具有未知系数的Zernike多项式的线性组合表示相位滤波器,通过基于最大化图像清晰度度量的迭代优化方案估计系数。
干涉合成孔径显微(Interferometric Synthetic Aperture Microscopy,ISAM)技术可以解决有限焦距引起的OCT横向分辨率降低问题,其中数据采集过程中的相位稳定是ISAM技术实现的基础,但对于活体视网膜成像由于眼睛的快速运动,为保证相位稳定性,其三维图像的采样速率往往需要达到几百Hz。2016年,Xu等[85]设计了自动干涉合成孔径显微镜并利用计算自适应光学改善光学相干层析成像的分辨率。同年,Hillmann等[86]将扫描源OCT与全场OCT相结合,在较高采样速率利用计算像差后处理技术校正视网膜成像的人眼像差。又是同年,Xiao等[87]将全场OCT与空间非相干光源结合使用,观察到像差只会影响信号强度,而不会影响图像的清晰度,为计算波前校正提供了新的思路。
2017年,Ginner等[39]在线场光谱域OCT系统中以2.5 kHz的速率进行层析成像,利用非迭代的数字像差校正(Digital Aberration Correction,DAC)方法实现在体视网膜OCT细胞级分辨率成像,并将DAC应用于功能性OCT血管造影。2018年,Laurin等[88]将数字自适应光学(DAO)应用在离轴全息高分辨率线场En-face OCT系统,实现2.8 μm的横向分辨率。同年,South等[89]将变形镜硬件波前校正和计算波前校正进行结合,更完整地校正了人眼像差,提高了活体人体光感受器细胞的信噪比和图像清晰度。
-
随着细胞和基因治疗的兴起,在活体组织评估中实现细胞分辨率的生物医学成像已经成为一个重要研究热点。OCT技术自首次验证以来一直被用于生物医学领域的无创、实时、在体光学活检,目前已经成为眼科成像诊断不可或缺的工具。文中对近10多年来自适应光学的发展及其在视网膜OCT成像中应用的国内外现状进行了归纳与分析,根据成像原理和数据处理方式的不同,OCT可分为时域OCT (TD-OCT)、光谱域OCT (SD-OCT)和扫描源OCT (SS-OCT)三大类,具有点扫描、线场和全场三种照明和检测方案。其中,光谱域OCT和扫描源OCT都属于频域OCT,已完全取代时域OCT,并逐步向视网膜实时、在体的三维立体成像发展。传统频域OCT在视网膜成像时可以实现很高的轴向分辨率,但由于人眼近视、远视、散光等个体差异、视网膜活检时眼球不自主运动、OCT系统色差等因素引入的OCT成像系统像差不可避免的限制了其横向分辨率,AO可以显著提高OCT横向分辨率,实现视网膜细胞及微细血管的近衍射极限成像,以及时发现患者眼底存在的早期病变。
根据波前测量和校正方式的不同,自适应光学技术可以分为基于波前传感器、波前校正器进行直接波前测量和校正的硬件自适应光学和利用无波前传感和计算波前校正技术进行间接波前探测和校正的数字自适应光学。对自适应光学在视网膜OCT成像领域的关键技术和未来发展趋势进行总结:
(1)宽带光源可以提高OCT的轴向分辨率,但需要校正色差,才能进一步提高AO-OCT的各向分辨率,通过使用消色差透镜和大行程变形镜校正色差和单色像差实现全光校正,已经成为获得各向同性高分辨率OCT成像的技术路径之一;
(2)由于自适应光学OCT的视场较小,一般需要在确定感兴趣区域后,再用AO-OCT进行该区域的高分辨率成像。大视场自适应光学系统的设计和图像采集速率的提高可以显著增大视网膜OCT成像的视场,是宽视场视网膜OCT成像的未来发展趋势;
(3)进行活体视网膜成像时,即使在正常注视下人眼也会发生不自主眼球运动而产生伪影,高速成像和图像配准已经成为减少眼球运动伪影的重要技术路径和未来发展方向;
(4)由于没有成像光学元件的限制,无波前传感器的AO可以大大简化AO-OCT系统,但视网膜波前无传感器系统的校正速度慢,校正随时间变化像差的能力较差,目前国内外众多科研机构都在探索新的OCT无传感器波前像差校正方法;
(5)与传统的基于硬件的自适应光学技术相比,光学像差的数值校正可以对每个成像深度的离焦进行校正,克服高分辨率系统固有的有限聚焦深度,在整个成像深度中进行高分辨率三维成像,新的计算波前校正方法在未来可能发展出临床上适用的下一代AO-OCT系统;
(6)近年来,随着自适应光学技术的进步,AO-OCT的应用范围不断扩展,AO-OCT血管造影(OCT Angiography,OCTA)已经成为一种快速的、非侵入性的新型血流成像技术。与标准OCTA成像相比,AO辅助系统提供的高采样效率可以提高血管对比度,并可以测量血管结构的三维延伸。除了人类视网膜成像,用AO-OCT进行实验动物成像也引起了人们的兴趣;
(7)随着量子光学技术的发展,基于量子光学技术的相干层析成像(Quantum-Optical Coherence Tomography,QOCT)逐步在生物医学领域得到应用[90],可以校正偶数阶色散,轴向分辨率比传统OCT技术提高两倍,是提升OCT成像性能的必然发展趋势,在未来有希望取代传统的生物医学成像技术。
Application of adaptive optics coherence tomography in retinal high resolution imaging
doi: 10.3788/IRLA20200333
- Received Date: 2020-09-06
- Rev Recd Date: 2020-09-26
- Available Online: 2020-11-03
- Publish Date: 2020-11-03
-
Key words:
- adaptive optics /
- high resolution retinal imaging /
- optical coherence tomography /
- wavefront sensing /
- wavefront correction
Abstract: Retinal optical coherence tomography (OCT) technology uses external low coherence light source to irradiate the fundus of the human eye, and interfere scattered signals of the fundus of the human eye to obtain the sectional image information of the human retina, so as to realize the non-invasive, real-time and in vivo optical biopsy of the human retina. The axial resolution of traditional optical coherence tomography in retinal imaging can reach more than 3 μm, but the transverse resolution of OCT can only reach about 15-20 μm due to individual differences and inevitable aberrations. Adaptive optics, as an advanced technology of wavefront correction, can correct OCT chromatic aberration and aberrations caused by limited field of view and eye movement, so as to improve the transverse resolution of OCT to less than 2 μm. Adaptive optics OCT can realize near diffraction limit imaging of retinal cells and microvessels to timely detect the early lesions in patients with fundus. Based on the introduction of the technical characteristics of adaptive optics and retinal optical coherence tomography, the development status of adaptive optics in retinal optical coherence tomography at home and abroad was reviewed, and the key technologies and future development trends of adaptive optics OCT retinal high-resolution imaging in wide-band light source chromatic aberration correction, eye movement artifact reduction, adaptive optics field of view expansion and wavefront sensing and correction system simplification were summarized, so as to realize high-speed retinal imaging with large field of view, high efficiency, high sensitivity and high resolution, and provide reference for the future research and application of adaptive optics OCT retinal imaging technology.













 DownLoad:
DownLoad: